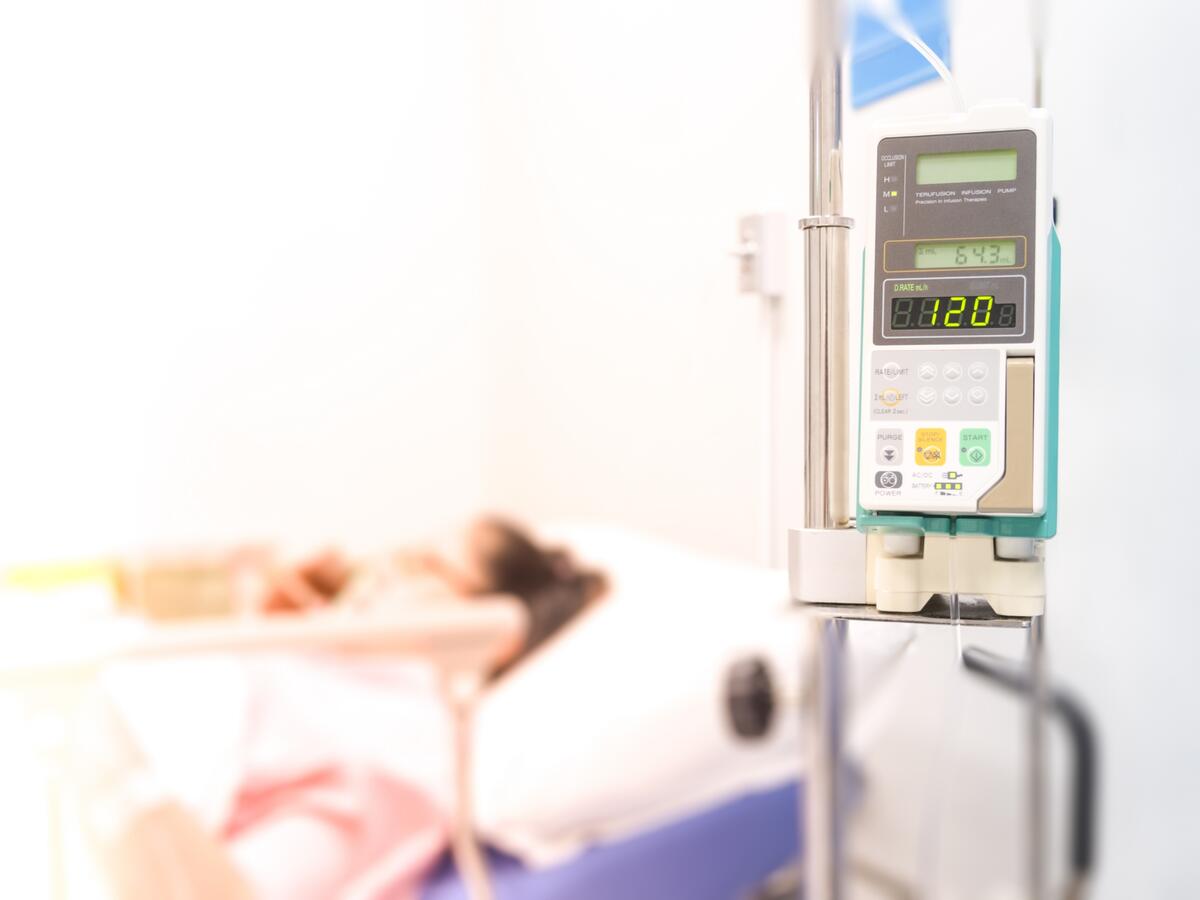
輸液ポンプは、救急救命や重篤な患者に使用されるため、安全性と性能要件を満たすための試験の実施が非常に重要です。 UL Solutionsは、IEC 60601-2-24 と IEC 60601-1-11 の両規格に対する輸液ポンプの試験と認証を支援することができます。
米国食品医薬品局 (FDA) は、2022 年 5 月に AAMI TIR101:2021 を承認規格として認めました。この規格には輸液ポンプの重要な性能基準が定められています。当社では、輸液ポンプの試験及びAAMI TIR101:2021 への適合を示すレポートへの対応などの支援が可能です。
当社の米国試験所(ミネアポリス)においては、AAMI TIR-101 で要求される試験環境が整っており、試験への対応が可能です。また、一部欧州やアジアの試験所においても試験機能を構築しています。
このAAMI TIR-101に基づく試験は、現在貴社が対応されている製品のFDA薬事申請への対応だけでなく、既存製品に対して独立した第三者の認証書が求められるような場合においても活用いただけます。
UL Solutionsを選ぶ理由
ヘルスケア、ヘルスサイエンス業界の発展をサポートする当社は、過去数十年にわたる技術、規制、および臨床環境における専門知識を活用し、規制上の課題に対応、および安全な製品を市場に投入するために支援してきました。
当社の試験及び評価担当の技術者は、国内外の標準化委員会と連携し、関連規格に関して最新動向の把握に日々努めております。 これらの委員会にはAmerican National Standards Institute (ANSI)、Association for the Advancement of Medical Instrumentation (AAMI)、及び International Electrotechnical Commission (IEC)などが含まれています。当社はアジア、ヨーロッパ、米国に米国FDAの ASCA認定試験所を複数所有しております。
お客様のニーズに合わせたワンストップでのソリューションを提供し、時間と費用の効果的な活用をご提案しております。当社の医療機器関連の包括的なサービスは、非臨床試験を中心に最終製品の試験、認証には、電気安全試験、電磁両立性(EMC)試験、ワイヤレス試験、相互運用性試験、ソフトウエア評価、サイバーセキュリティ試験、そして生体適合性試験などが含まれ、お客様の製品のグローバル展開を支援いたします。
弊社のセールスチームまでお問合せください
弊社の製品およびサービスにご関心をお寄せいただき、ありがとうございます。担当者からご連絡できるよう、お客様の情報をお知らせください。