提升受监管行业的合规性和 GxP 水平
ComplianceWire 是一个符合 FDA CFR Part 11 验证要求的合规培训管理系统,可适配培训规模,以应对监管要求和行业标准。该系统可助力确认法规要求,自动完成培训并实施风险管理,以支持开发更安全、更有效的医疗产品。
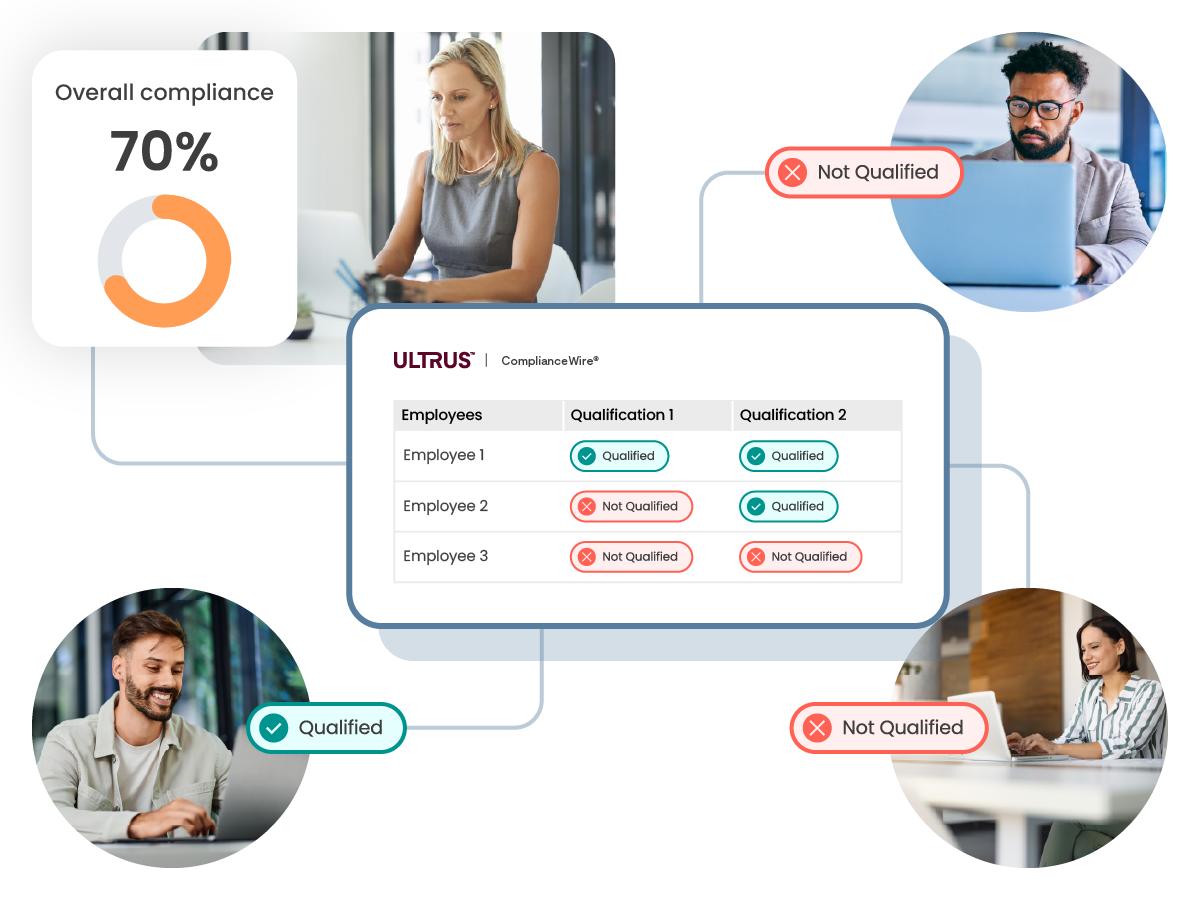
了解员工资质和培训情况
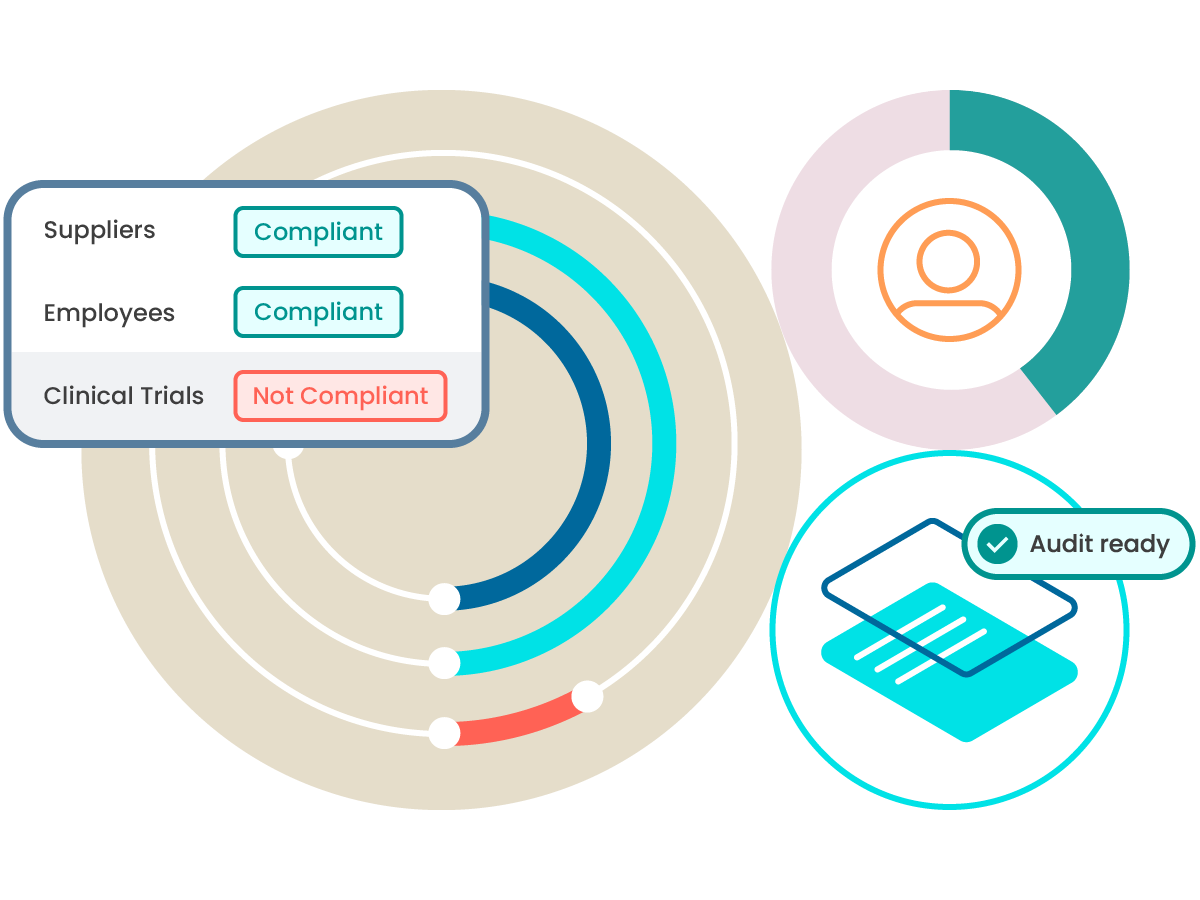
跟踪和监督贵司员工的资质和培训状态,以确认整体合规性,或深入了解已发现存在改进机会和风险的领域。
资质概览
仪表板和报告可提供整个组织的合规性和资质状态概览。
资质矩阵
实时深入了解每个团队及其资质,以准确了解会影响合规性的缺失部分。
进度报告
为团队领导提供进度报告,支持积极推动培训和资格认证。
协助简化并自动完成员工资质认证流程
轻松与员工沟通并对其进行监督,跟进审核后发现项 (CAPA) 并履行其他法规要求的义务。上传所需的培训资料、资质和政策资料,以保持合规性。
自动化培训
用户可轻松参与动态的在线学习课程,以扩大培训规模。
完全可配置
创建不同的标准机制,以满足合规性要求,建立团队组织结构,并与更广泛的生态系统整合。
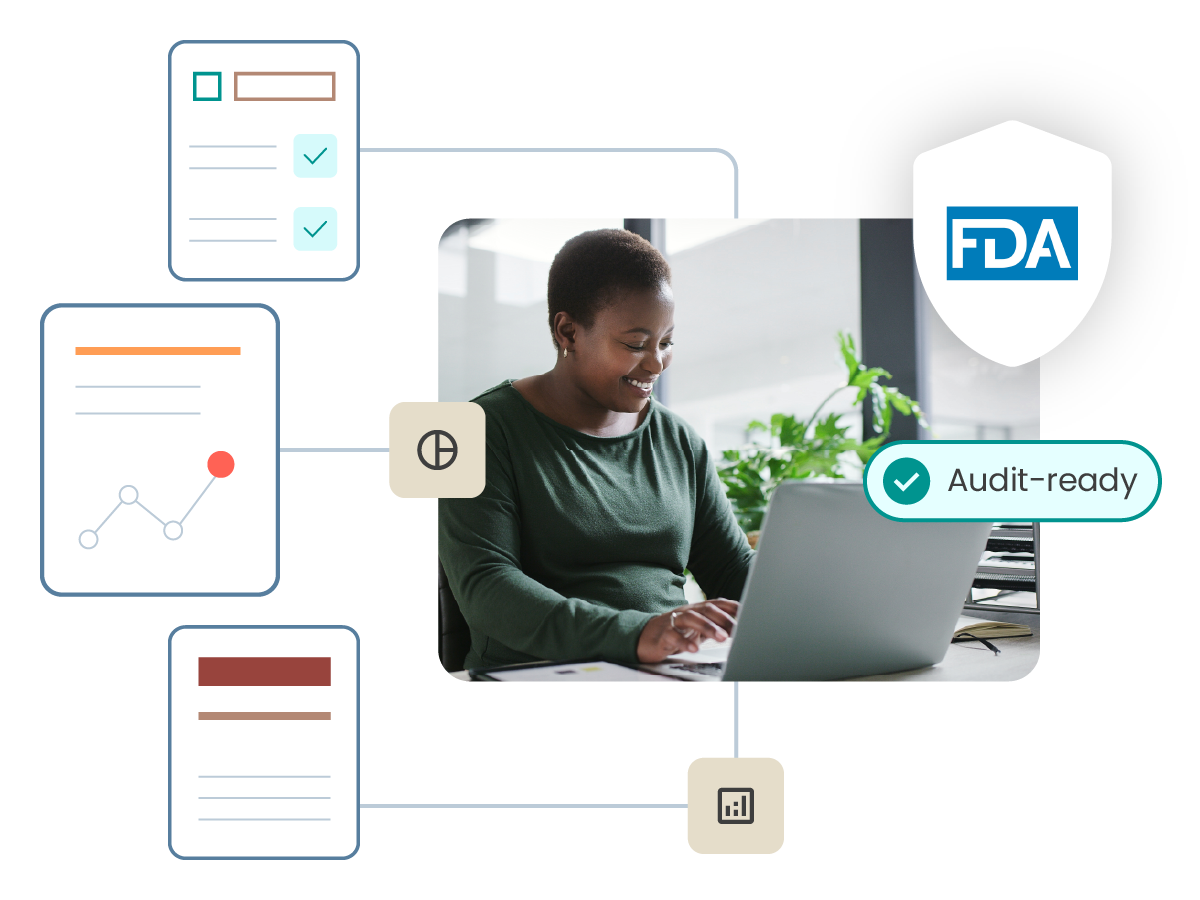
随时准备应对审核或监管机构的询问
ComplianceWire 本身就符合 FDA 21 CFR Part 11 的标准,并预置了众多监管机构要求的报告,可助力您自信应对来自监管机构和内部部门的审核。
审核应对支持
利用 ComplianceWire 团队,做好准备,获取支持,应对来自监管机构的询问。
久经考验的信任
ComplianceWire 定期接受内部审计和客户审计。我们的客户平均每年对 ComplianceWire 进行 50 多次审计,包括纸质、远程和现场审计。
通过 ComplianceWire提供的生命科学在线学习资料库增长专业知识
让我们助力您改善合规性,应对美国食品和药物管理局 (FDA) 对医疗器械和药品的监管要求。我们的课程目录中包含 400 多门生命科学在线学习课程,其中许多课程是与 FDA 共同开发的。
监管专业知识
美国 FDA 编写和/或审核的课程,与 FDA 为培训其检查员和调查员而使用的课程相同。
引人入胜的内容
包括固定格式的专题视频、嵌入式互动和测验,由熟练的课程设计专家制作。
在业务流程中提高质量和合规性
提高质量管理意识,不仅关注制造质量,更将质量作为助力整个企业降低风险的重要支柱。
临床试验
通过涵盖临床试验的资质要求,支持推进积极的患者结局,为临床研究提供助力。
社会责任
助力支持员工、合作伙伴和供应商按照与您的品牌相关的专业标准进行改善。
ComplianceWire 和 ULTRUS 软件
ComplianceWire 现在是 ULTRUS 软件的组成部分,ULTRUS 汇集了 UL Solutions 的旗舰数字产品,以助力客户应对监管、供应链和可持续性挑战。
准备好提升您的生命科学培训和在线学习能力了吗?
安排演示,以了解 ComplianceWire 如何助力您应对复杂的监管要求。