数字化转型
数字化正在重塑医疗器械行业。由人工智能 (AI) 驱动、基于云计算的智能数字健康应用、医疗器械独立软件 (SaMD) 以及医疗物联网 (IoMT) 正不断推动行业创新与发展。
为了应对由软件驱动、创新引领的行业变革,医疗器械的设计流程与上市后监管亟需采用新的方法,以有效证明软件工程的卓越性与合规管理能力。
医疗器械设备的数字生态系统
为助力客户缩短产品上市时间,专业的医疗器械设备制造商现已成功采用以软件为中心的开发方法。
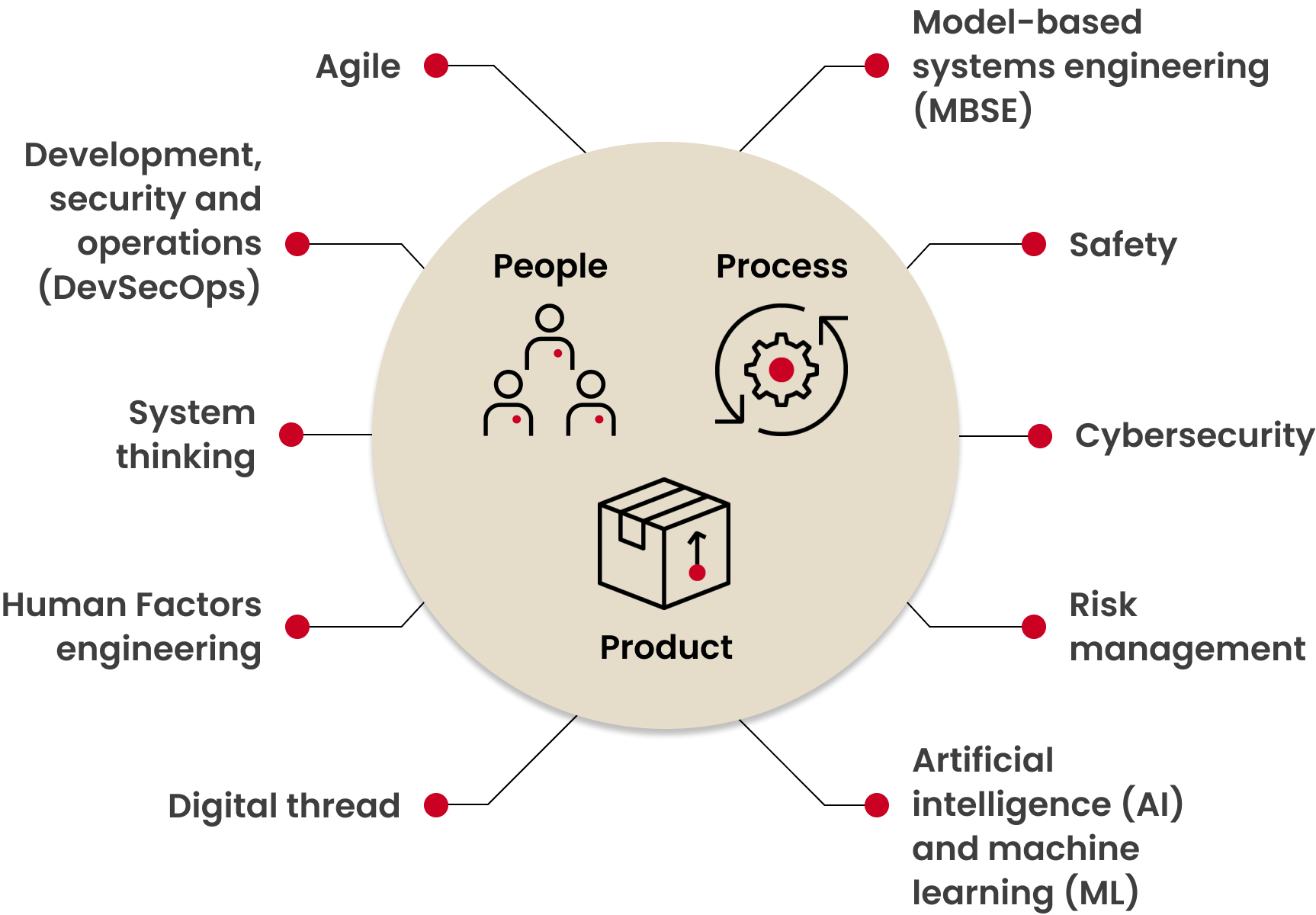
下图展示了影响并优化医疗器械软件设计的关键主题。要实现真正的提升,需采用整体性的系统工程方法,而非将各项举措孤立推进。

医疗器械设备的流程管理
Stages 是一个成熟可靠的平台,能够帮助构建并推广集成化的流程体系,全面覆盖医疗软件设计中的关键要素。
Stages 通过以下方式助力客户加快产品上市:
- 构建高效开发流程模型
- 推动新方法与新技术的快速应用
- 消除设计团队之间的信息孤岛。

提供合规支持
Stages 拥有独特的功能,能够显著降低企业在证明符合法规和行业标准方面所需的工作量。
Stages 可协助工程师应对复杂且不断变化的医疗器械设备监管环境,包括以下法规和标准:
- 美国食品药品监督管理局 (FDA)《联邦法规汇编》第21篇,第820部分。
- 《欧盟医疗器械法规》(MDR)
- 国际电工委员会 (IEC) 62304:《医疗器械软件——软件生命周期过程》
- 国际标准化组织 (ISO) 14971:2019《医疗器械——风险管理对医疗器械的应用》
- 国际标准化组织 (ISO) 13485:2016《医疗器械——质量管理体系——用于法规的要求》
- 国际电工委员会 (IEC) 82304-1:《健康软件 第1部分:产品安全的通用要求》
- 国际电工委员会 (IEC) 81001-5-1:2021《健康软件和健康信息技术系统的安全性、有效性与安全性 第5-1部分:安全性——产品生命周期中的活动》
- 美国 FDA 指南:《医疗器械的网络安全:质量体系考虑因素和上市前提交的内容》
- ISO 27799:《健康信息学——基于 ISO/IEC 27002 的卫生信息安全管理》
西门子医疗
“Stages 软件帮助团队高效协作,规范流程,并帮助工程师以最优方式开展工作。”

Shamron Awwal | 高级流程工程师 | 西门子
卓越工程管理
依托我们工程师与顾问的专业积累,帮助客户打造高效、合规、可持续的医疗器械系统与软件工程管理体系。
我们在以下领域拥有深厚的专业积累与实践经验:
- 医疗软件和系统开发。
- 根据 IEC 62304 标准开发医疗软件。
- 根据 ISO 14971 标准实施风险分析。
- 根据 IEC 62366 标准实施可用性工程流程。
- 支持软件开发流程的设置,从而有效满足法规要求。
- 根据美国医疗仪器促进协会 (AAMI) 技术信息报告第45号 (TIR45),开展主动医疗器械的敏捷开发。
联系我们
感谢您关注我们的产品和服务。我们将收集一些信息,安排合适的人员与您联系。